Essentielle et incontournable pour nos sociétés modernes, l’industrie chimique permet de fabriquer, synthétiser les principes actifs de nombreux médicaments, certains conservateurs alimentaires, des arômes, nos parfums, etc…
Comme toute industrie, elle se doit de gérer le stock de réactifs qu’elle achète et de prévoir les quantités de produits qu’elle synthétise. L’un des outils du chimiste pour prévoir les stocks à acheter et prédire les quantités produites à vendre est le tableau d’avancement.
Introduction : Prévision des stocks et de la production
A l’aide des simulations d’expérience ci-dessous, réalisez le travail demandé.
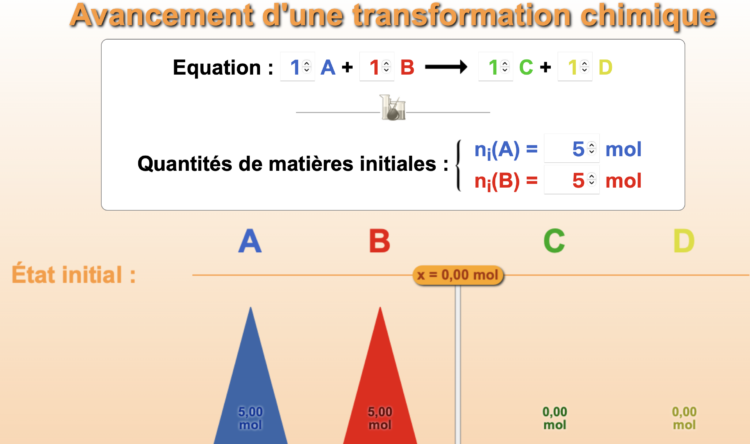
Introduction à l'avancement d'une réaction
Cette animation vous permettra de jouer avec les quantités de réactifs (pain, molécules…) pour constater la quantité de produits apparaissant et les restes. A la fin de cette simulation, des exercices d’entraînement vous sont proposés.
Vous êtes manager dans une sandwicherie et vous devez gérer les stocks de nourritures. Les sandwichs fabriqués comportent tous 2 tranches de pain, 1 tranche de jambon et 1 fromage.
- Sélectionner l’icône « Sandwiches » en bas de la simulation pour vous aider dans votre raisonnement.
Travail :
- Si vous disposez de 17 tranches de pain, 10 tranches de jambon et 13 de fromage, combien de sandwiches pourriez-vous fabriquer ?
La réponse peut aussi être trouvée de tête. Mais on se rend vite compte que si les stocks deviennent importants, il sera nécessaire de trouver un moyen de consigner tout cela plus clairement : le tableau d’avancement.
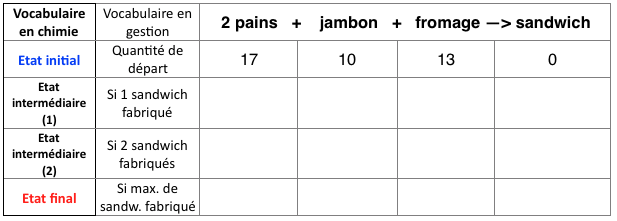
- Si vous disposez de 10 tranches de pain, 4 tranches de jambon et 15 de fromage, combien de sandwiches pourriez-vous fabriquer et que vous restera-t-il ?
- Même question pour 18 pains, 7 jambons et 24 fromages.
Le tableau d'avancement
A l’aide de la simulations d’expérience ci-dessous, réalisez le travail demandé.
Avancement pas à pas de réactions chimiques
Cette animation vous permettra de paramétrer un tableau d’avancement en fonction des quantités de matières de votre exercice. Puis vous pourrez faire évoluer l’état intermédiaire pour suivre, en direct, sous forme graphique et numérique, l’évolution des quantités des réactifs et produits.
En chimie, nous manipulons des quantités gigantesques d’entités : un simple verre d’eau contient à peu près des centaines de milliers de milliards de milliards de molécules d’eau : 1023 molécules d’eau. C’est pour cela que le tableau d’avancement en chimie ne sera rempli qu’avec des quantités de matières n en mol ou mmol, etc…
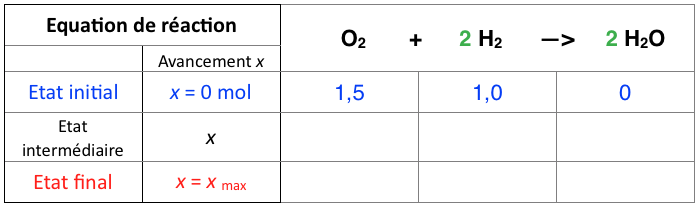
Réaction chimique entre le dioxygène et le dihydrogène
Travail :
1,0 mol de dioxygène réagit avec 1,5 mol de dihydrogène pour former une certaine quantité d’eau. Déterminer la quantité d’eau formée à la fin.
Remarque : des aides sont proposées ci-dessous si vous bloquez.
- Écrire et équilibrer l’équation de réaction.
- Dresser le tableau d’avancement et compléter la ligne « État initial » avec les quantités de matière initiales ni.
- Trouver la quantité de matière finale nf de l’eau mais aussi des réactifs (vous pouvez vous aider de la simulation)
O2 + 2 H2 —> 2 H2O

Donc nf (O2) = 1,0 mol ; nf (H2) = 0,0 mol ; nf (H2O) = 1,0 mol
L'avancement d'une réaction
La simulation met en évidence qu’une réaction chimique avance… Pas comme une voiture évidemment. Elle « avance » lorsque les réactifs entrent en contact les uns avec les autres (pour plus de détails là-dessus, aller à la page suivante : vitesse de réaction)
Pour rendre compte de ce fait, les chimistes utilisent l’avancement (noté x) de la réaction.
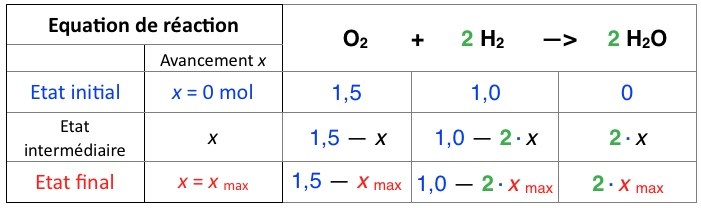
Le tableau précédent devient alors :
Description des différents états de la réaction
A l’état initial, la réaction n’a pas démarré. L’avancement x vaut naturellement 0 mol.
A l’état intermédiaire, la réaction « avance » dans le temps. On montre cela par l’augmentation de l’avancement x : la simulation précédente nous montre bien que x augmente toujours.
On constate que l’avancement est unique : sa modification entraine la modification des quantités des autres espèces chimiques.
Exemple : Le dihydrogène disparait 2 fois plus vite : sa quantité diminuera donc 2 fois plus vite que pour le dioxygène. On modélise cela ainsi dans le tableau d’avancement :
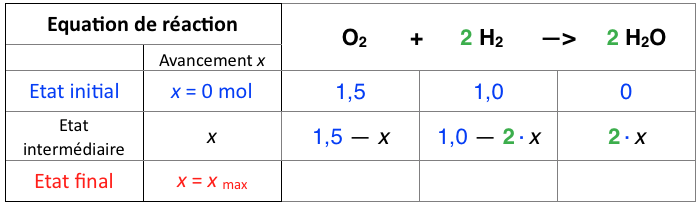
Au bout d’un moment, la réaction s’arrête : il n’y a plus de réactif. La réaction est alors à l’état final. L’avancement de la réaction a atteint son maximum : x max.
Comment déterminer le réactif limitant, donc x max ?
Méthode 1 : L’évidence
On trouve facilement le réactif limitant puisque les coefficients stœchiométriques et les quantités initiales ne laissent pas de place au doute.
Dans notre exemple, on a voit bien que H2 est le réactif limitant : il disparait 2 fois plus vite ET il est en plus petite quantité.
On peut alors écrire :
nf (H2) = 0 mol
Or d’après le tableau d’avancement : nf (H2) = 1,0 – 2xmax.
On peut donc poser : 1,0 – 2xmax = 0
Soit xmax = 0,50 mol.
Méthode 2 : En posant des hypothèses
Hypothèse n° 1 : O2 est le réactif limitant.
On peut alors écrire :
nf (O2) = 0 mol = 1,5 – xmax
Soit xmax,1 = 1,5 mol.
Hypothèse n° 2 : H2 est le réactif limitant.
On peut alors écrire :
nf (H2) = 0 mol = 1,0 – 2xmax
Soit xmax,2 = 0,50 mol.
L’avancement ne peut pas aller au-delà de ce que le réactif limitant peut faire.
Si xmax,2 < xmax,1
Alors H2 sera le réactif et xmax = 0,50 mol.