Les processus chimiques sont omniprésents dans notre quotidien. Aussi bien pour le bon fonctionnement de notre corps (digestion, combustion de nutriments…) que pour la synthèse de principes actifs de certains de nos médicaments, d’arômes, de conservateurs…
Ces réactions chimiques sont parfois tellement rapide qu’elle nous semblent instantanées ; comme les explosions.

Mais bien souvent elles sont lentes, voir très lentes :
- L’hydrolyse des glucides au cours de la digestion
- la transformation des dépôts organiques en pétrole qui met des millions d’année.
- La formation de rouille sur des carcasses métalliques.

Lorsqu’un industriel se lance dans la synthèse d’une espèce chimique, il faut donc qu’il regarde si :
- la vitesse de la réaction qu’il cherche à réaliser est lente ou rapide afin de ne pas perdre de temps.
- la réaction de la synthèse est totale ou partielle afin de maitriser le rendement.
A voir dans ce cours
- Identifier des facteurs cinétiques
Autres cours à consulter
Identifier des facteurs cinétiques
A savoir : Une réaction chimique se déroulera d’autant plus vite que les chocs entre réactifs seront rapides et efficaces.
A l’aide de la simulation d’expérience, réalisez le travail demandé ci-dessous.
Simulation d'une réaction chimique
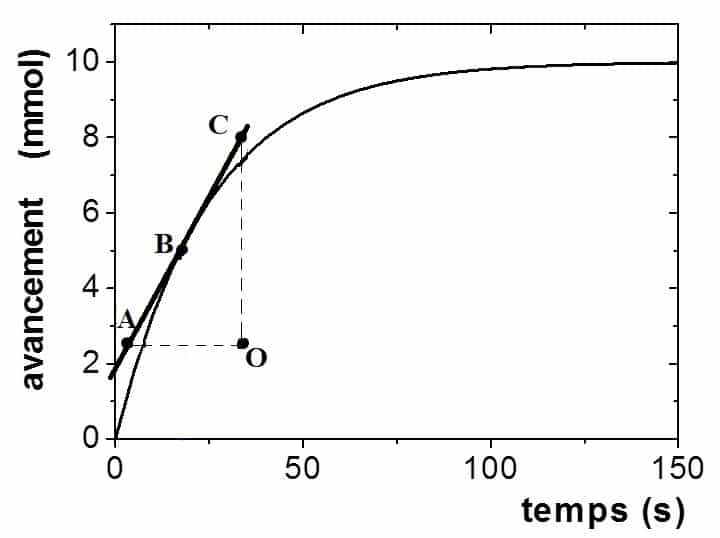
Cette simulation nous permet de visualiser les chocs entre réactifs et de suivre graphiquement l’évolution des quantités des espèces chimiques dans le cas d’une transformation totale ou non totale.
Sur quelles grandeurs peut-on jouer pour accélérer une réaction ?
- Par défaut, la simulation est paramétrée pour une réaction totale (Sens inverse : proba = 0) ; laisser ainsi.
- Lancer l’animation et observer ce qui se passe sur le graphique et pour les particules.
Travail :
- Sans toucher aux « Probabilités de chocs efficaces », trouver les 2 paramètres de la simulation qui permettent d’augmenter la vitesse de la réaction.
- Relier chacun des 2 paramètres à une grandeur physique mesurable. Ce seront nos facteurs cinétiques.