Pour offrir les meilleures expériences, nous utilisons des technologies telles que les cookies pour stocker et/ou accéder aux informations des appareils. Le fait de consentir à ces technologies nous permettra de traiter des données telles que le comportement de navigation ou les ID uniques sur ce site. Le fait de ne pas consentir ou de retirer son consentement peut avoir un effet négatif sur certaines caractéristiques et fonctions.
Le stockage ou l’accès technique est strictement nécessaire dans la finalité d’intérêt légitime de permettre l’utilisation d’un service spécifique explicitement demandé par l’abonné ou l’utilisateur, ou dans le seul but d’effectuer la transmission d’une communication sur un réseau de communications électroniques.
Le stockage ou l’accès technique est nécessaire dans la finalité d’intérêt légitime de stocker des préférences qui ne sont pas demandées par l’abonné ou la personne utilisant le service.
Le stockage ou l’accès technique qui est utilisé exclusivement à des fins statistiques. Le stockage ou l’accès technique qui est utilisé exclusivement dans des finalités statistiques anonymes. En l’absence d’une assignation à comparaître, d’une conformité volontaire de la part de votre fournisseur d’accès à internet ou d’enregistrements supplémentaires provenant d’une tierce partie, les informations stockées ou extraites à cette seule fin ne peuvent généralement pas être utilisées pour vous identifier.
Le stockage ou l’accès technique est nécessaire pour créer des profils d’internautes afin d’envoyer des publicités, ou pour suivre l’internaute sur un site web ou sur plusieurs sites web ayant des finalités marketing similaires.




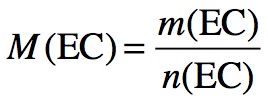
Comment le nombre d’Avogadro a-t-il été déterminé ?
Il serait intéressant de l’expliquer pour les plus curieux.
Bonjour Choukrov
Bonne remarque : j’ai rajouté 2 liens web qui pourraient satisfaire les curieux.
Bonjour ma question est la suivante dans certain exo jarrive a appliquer la formule, mais mon soucis est quil donne un resultat en 10^–
Exemple 5.0 mg quil faut convertir en Gramme M=173 g.mol
D’après leur correction 5,0.10^-3 ÷ 173= 2.89.10^-5 MOL
comment font til pour que lecriture final ressemble a sa car moi je narrive pas a faire de cet manière.
Merci
Bonjour Nana
Ton souci concerne peut-être ta maitrise de l’écriture scientifique des résultats d’un calcul.
Cela peut aussi venir de ta calculatrice. Si c’est celle du collège, elle ne doit pas afficher le résultat en écriture scientifique (c’est à dire : 2,89 x 10-5) mais classiquement : 0,0000289.
Je pense avoir retrouvé l’énoncé de ton problème et te propose une correction détaillée sur page web ci-dessous :
https://www.phychiers.fr/exercices-avec-la-masse-molaire/#masse_molaire_acetyl_leucine_quantite
Espérant t’avoir aidée.
« N » c’est quoi svp
Bonjour Harlay
Par convention, le symbole « N » est l’abréviation de « Nombre d’entités » ; sachant qu’une entité peut-être ce que tu veux. Mais en chimie, les entités sont des atomes, molécules ou ions.
Exemple : N(chaussure) = 10 chaussures
N(ion) = 5 milliards d’ion.
Bonjour,
Est-ce que pour déterminer une mole de molécule on fait M=m(entités)xNa ?
Bonjour. Il faut faire attention aux majuscules et minuscules en physique-chimie : M est la masse molaire, m est la masse et Na le nombre d’Avogadro. Ta formule est donc fausse.
Si je comprends bien ta question : pour déterminer le nombre de mole (on préférera dire « déterminer la quantité de matière en mole ») pour une molécule, il faut faire : n = N / Na ; avec n la quantité de matière en mole, N le nombre d’entités.
J’espère avoir répondu à ta question.