Formule à savoir :
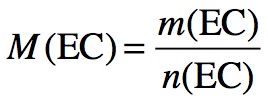
Je sais effectuer un calcul si …
- J’ai écrit la formule littérale adéquate
- J’ai personnalisé la formule littérale
- J’ai calculé correctement (calculette + conversion)
- J’ai mis le bon nombre de chiffres significatifs CS
- J’ai mis la bonne unité à la fin du calcul
Cours à consulter
Les données
M (H) = 1,0 g/mol
M (C) = 12,0 g/mol
M (N) = 14,0 g/mol
M (O) = 16,0 g/mol
M (S) = 32,0 g/mol
M (Cu) = 63,5 g/mol
Exercices commentés pas à pas en vidéo
La vidéo présente la formule et propose des conseils pour résoudre des exercices calculatoires.
Source – chaine Youtube : « phychiers »
Pour vous entrainer

Exercice 1 : Masse molaire de l'eau
Donc la masse molaire des molécules d’eau est de 18,0 g/mol.
Exercice 2 : Masse molaire du sucre
Donc la masse molaire des molécules de sucre est de 180,0 g/mol.
Exercice 3 : Masse molaire du sulfate de cuivre
Donc la masse molaire du solide ionique sulfate de cuivre est de 159,5 g/mol.
Exercice 4 : Sucre à prélever
Donc la masse de sucre à prélever est de 131 g.
Exercice 5 : Sulfate de cuivre
Donc la quantité de matière de sulfate de cuivre est de 29,3 mmol.
Exercice 6 : L'acétyl-leucine
Un médicament qui lutte contre les vertiges contient 5,0 mg d’acétyl-leucine de formule brute C8H15O3N. L’acétyl-leucine constitue le principe actif de ce médicament.
1/ Calculer la masse molaire de l’acétyl-leucine.
2/ Déterminer la quantité de matière en acétyl-leucine contenue dans ce médicament.
Donc la masse molaire de l’acétyl-leucine est de 173,0 g/mol.
Donc la quantité de matière d’acétyl-leucine est de 29 μmol.


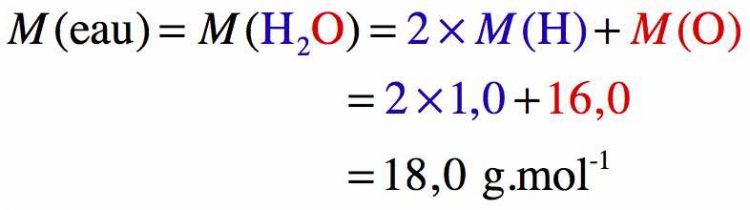
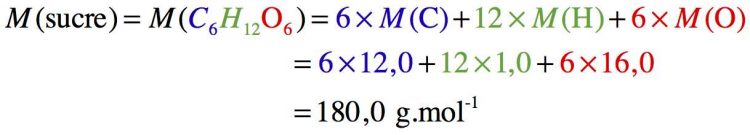





Exercices ludiques et bien expliqués. Merci vraiment.
Merci Ana pour ce retour 🙂
Merci ça m’a beaucoup aidé
De rien
le site est vraiment incroyable il n’y a aucune erreur de calcule. Pas comme dans certain site haha
Merci Harlay pour ce retour.
Par contre, il m’arrive de laisser passer quelques coquilles tout de même.
Il ne faut pas hésiter à me les signaler.
Merci beaucoup, super pour réviser
Merci du retour. Bonne révision.
Mercii beaucou Vous me sauvez
Merci pour cette avance rapide dans mais devoir
Super-utile ! Pour débuter dans la lesson, ces exercices sont top ! Cependant j’aurais bien aime que les exercices aient un niveau un peu plus élevé pour les revisons plus poussées ou des classes supérieures.
Merci pour ce retour. J’y pense : quand j’aurai plus de temps pour développer encore plus tout cela.
Merci beaucoup ❤
De rien 🙂