Le contexte de l'époque
A l’époque de Rutherford, les scientifiques savaient que la matière était constituée d’une partie électriquement chargée négativement et d’une autre chargés positivement. Le tout coexistant dans un milieu homogène et dense : c’est le modèle de Thomson ou du plum pudding
A voir dans ce cours
- Le modèle planétaire
- Du vide dans la matière ?
Autres cours à consulter
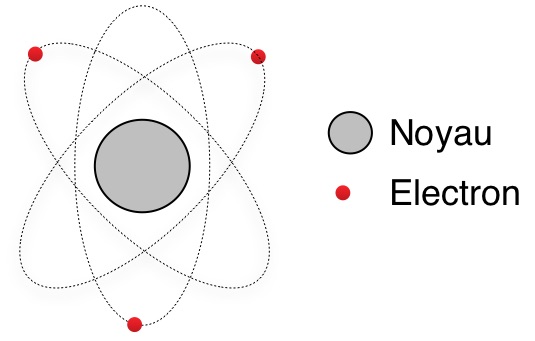
Le modèle planétaire

- Les atomes sont constitués d’un noyau (particule chargé positivement) ET à 99% de vide…
- Les atomes sont constitués d’électrons (particules chargées négativement)
Construire un atome
Cette animation vous permettra de construire des atomes ou ions, stables ou instables (=radioactivité) à partir des constituants élémentaires : protons, neutrons et électrons.
Comment Rutherford découvrit l'existence du vide dans la matière ?
Comme le montre la vidéo et l’animation ci-dessous, en bombardant une feuille d’or avec des noyaux d’hélium (chargés positivement +), Ernest Rutherford se rendit compte que la majorité des noyaux d’hélium passait à travers la feuille …
L’expérience de Rutherford
Vous pourrez simuler l’expérience de Rutherford dans le cas du modèle planétaire de la matière ou du modèle du Plum pudding et ainsi confronter la véracité des deux modèles.
L’expérience de Rutherford
Cette vidéo reprend pas à pas le principe de cette expérience qui permit de mettre en évidence l’existence du noyau atomique et du vide qui constitue matière.

