Le contexte de l'époque
A l’époque de Bohr, les scientifiques savaient que la matière était constituée d’un noyau chargé électriquement positif et de particules négatives (=les électrons) orbitant dans le vide autour du noyau : l’expérience de Rutherford prouvait ce modèle.
Mais ce modèle planétaire n’était pas satisfaisant puisque la physique classique prévoyait alors que les électrons devaient nécessairement s’effondrés sur leur noyau, rendant impossible l’existence des atomes, donc des molécules, donc de nous… Quelque chose clochait !
Autres cours à consulter
Tableau périodique & Structure électronique
Ce simulateur vous permettra de répartir les électrons d’un atome sur ses différentes couches électroniques et de visualiser sa répartition électronique ainsi que sa place dans le tableau périodique.
L'apport du modèle de Bohr
Son modèle est compatible avec les quantas d’énergie lumineux (les photons) d’Einstein. Il permet d’expliquer :
- le problème du modèle planétaire de Rutherford : les électrons devaient s’effondrer sur leur noyau selon la théorie de Maxwell.
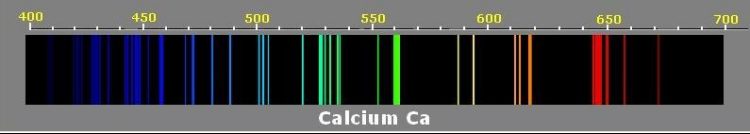
- les spectres de raies d’émission (ci-dessous du Calcium)
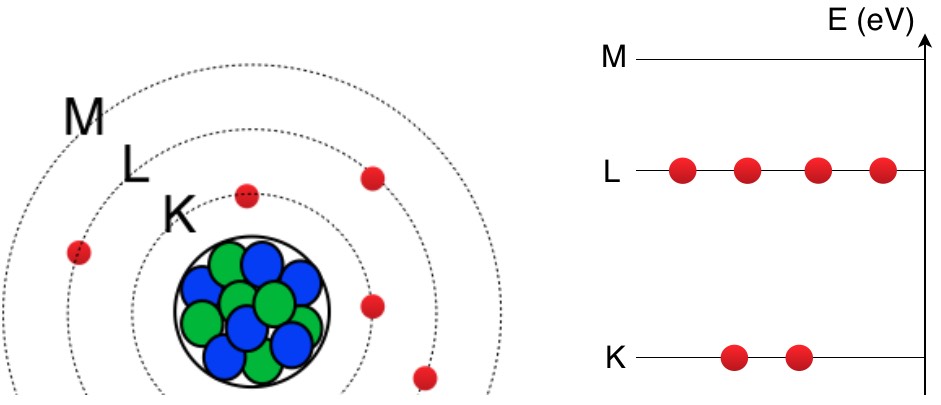
Le modèle atomique de Bohr en classe de seconde
Les couches électroniques vu en seconde (K, L, M ou 1s, 2s, 3p…) correspondent à des niveaux d’énergie que les électrons occupent.
Couche électronique (K, L, M)
Du schéma de l’atome de carbone, la structure électronique de l’atome de carbone sera : K2L4
Couche électronique (s, p, d, f)
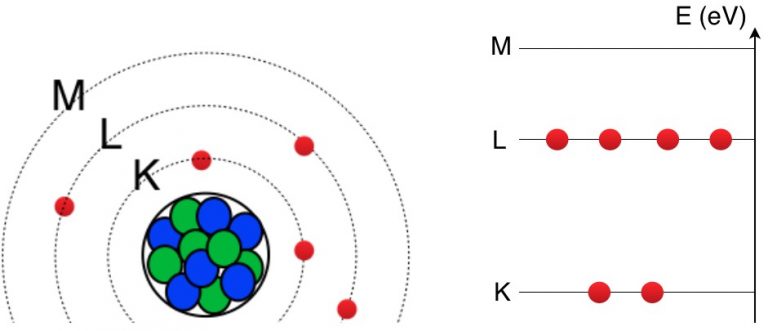
Le modèle atomique de Bohr en classe de Spé
Il y a donc des niveaux d’énergie acceptables dans lesquels les électrons peuvent évoluer et d’autres niveaux inacceptables. On dit que les électrons doivent circuler sur des orbites discrètes (bien précises) autour du noyau.
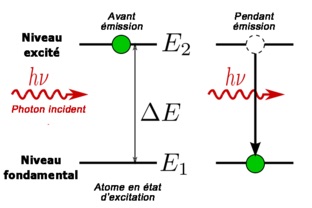
Les électrons peuvent passer d’un niveau à un autre : ils sont excités grâce à l’absorption d’un photon.
Puis les électrons retombent à leur état fondamental : ils se désexcitent en émettant un photon.


