Définitions
Dosage : Mesurer la concentration d’une solution.
Titrage : on s’appuie sur une réaction chimique entre une solution de concentration connue C1 (=solution titrante) qui va réagir avec la solution à titrer (ou doser)
En suivant l’évolution de paramètres physiques mesurables (pH, conductivité) ou observables (couleur), on peut déterminer le volume équivalent (Véq).
Le dosage par titrage expliqué en vidéo
La vidéo s’appuie sur les notes de cours développées ci-dessous.
Source – chaine Youtube : « phychiers »
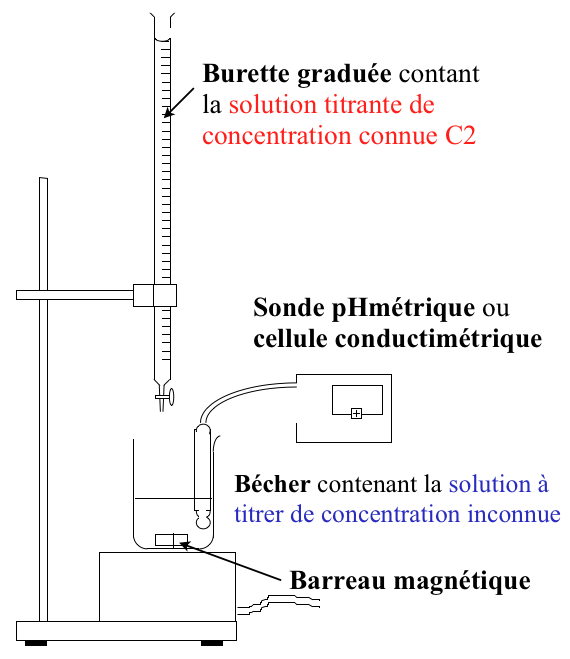
Protocole d'un titrage
- Préparer la solution titrantes de concentrations connus et remplir la burette avec.
- Verser millilitre par millilitre la solution titrante dans la solution à doser.
- Mesurer la grandeur physique (le pH ou la conductivité) à chaque ajout en solution titrante.
- Tracer un graphique : pH = f (V) ou σ = f (V) )
- Mesurer le volume équivalent Veq visible par une rupture de pentes.
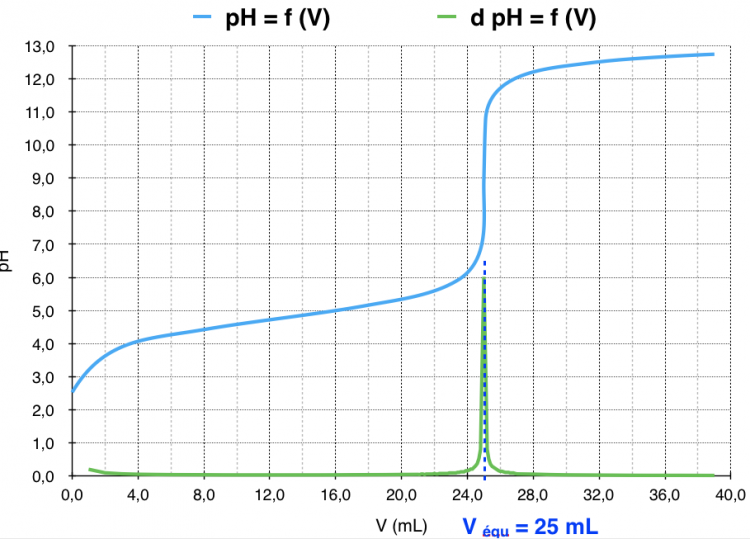
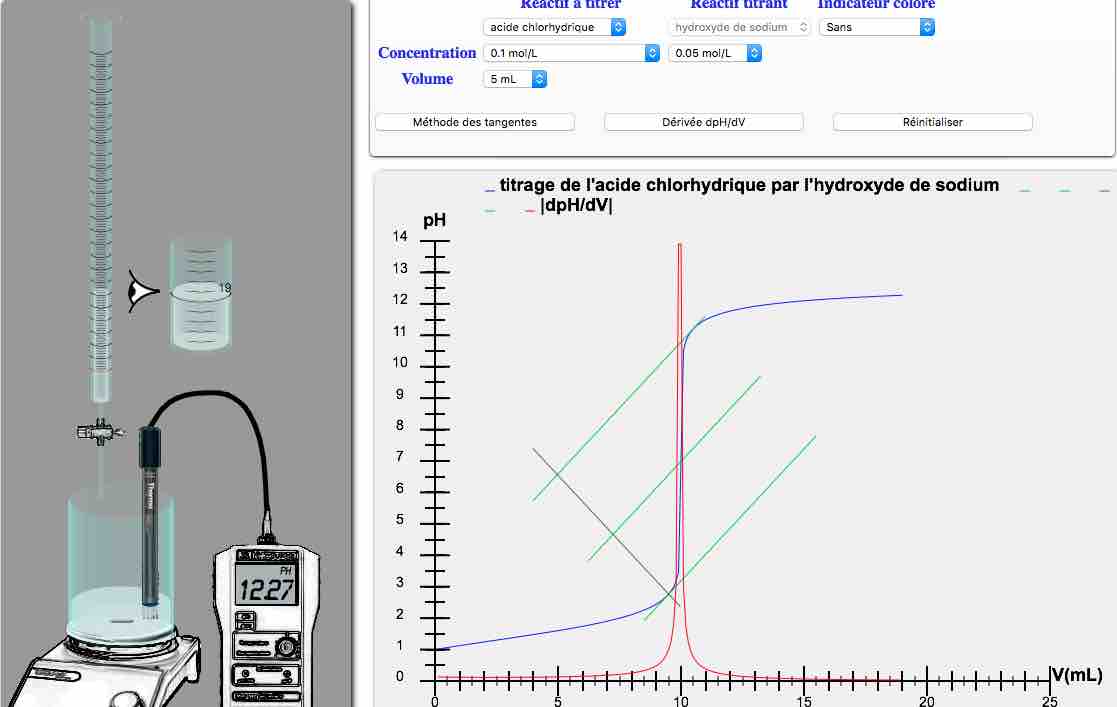
Dosage par titrage pHmétrique
- Les croix bleues ciels correspondent aux mesures de conductimétrie à chaque ajout de NaOH.
- Le pic vert correspond au volume équivalent : volume où la réaction du titrage atteint les proportions stoekiométriques :
Suivi par titrage pHmétrique
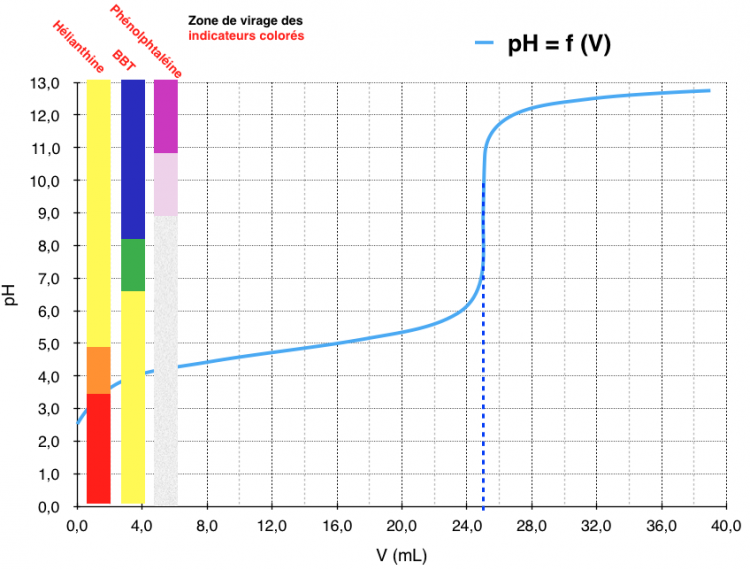
Dosage par titrage colorimétrique
Objectif : Déterminer la concentration en acide étanoïque (CH3COOH) d’une solution en suivant la réaction par colorimétrie.
- Avant de titrer, il faut au préalable avoir une petite idée de la valeur du saut de pH afin de choisir le bon indicateur coloré.
- On voit bien que pour le dosage de l’acide éthanoïque précédent, l’utilisation de la phénolphtaléine est judicieuse
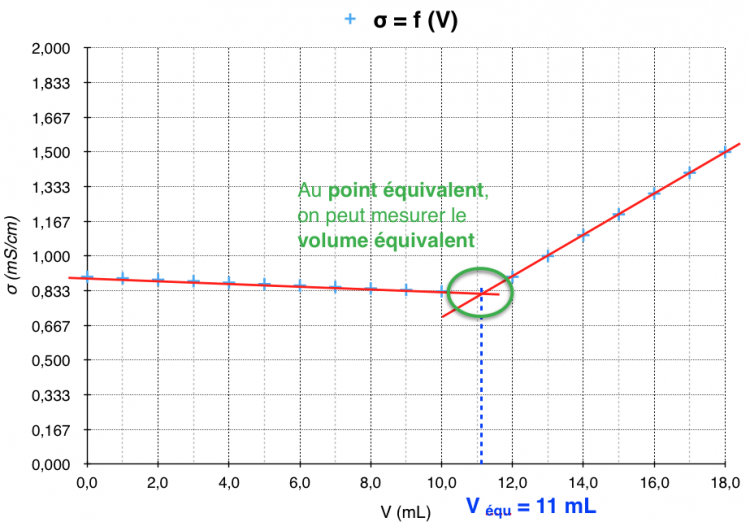
Dosage par titrage conductimétrique
Objectif : Déterminer la concentration en sel (chlorure de sodium NaCl) d’une solution en suivant la réaction par conductimétrie
On utilisera du nitrate d’argent (AgNO3) comme solution titrante qui formera un précipité blanc de NaCl selon l’équation de réaction : Cl– + Ag+ → AgCl
- Les croix bleues ciel correspondent aux mesures de conductimétrie à chaque ajout de AgNO3.
- Les pointillés bleus correspondent au volume équivalent : volume où la réaction du titrage atteint les proportions stoekiométriques :
Dans le cas où Véq = 11 mL, on pourra calculer la concentration en ions Cl– et donc la concentration en NaCl.
Dosage par titrage conductimétrique (& Dosage par étalonnage)
Vous simulerez un TP qui cherche à déterminer la concentration en chlorure de sodium d’un sérum physiologique. Vous pourrez :
- préparer la droite d’étalonnage pour doser par étalonnage une échelle de teinte
- ou simuler le dosage par titrage de la solution de concentration inconnu à l’aide d’une solution de nitrate d’argent.
Comprenons la rupture de pente lors du titrage conductimétrique
Que ce soit pour un titrage conductimétrique ou ph-métrique, nous repérons l’équivalence grâce à une rupture de pente qui nous permet alors de mesurer le volume équivalent.
L’équivalence n’est autre que le moment où nous avons mis suffisamment de titrant (burette) pour que les réactifs soient dans des proportions stœchiométriques.
Mais que se passe-t-il pour qu’il y ait des sauts de pH ou des ruptures de pentes lors d’un titrage ?
La rupture de pente
Ci-dessous, deux graphiques interactifs vous permettent de visualiser ce qu’il se passe :
- dans le becher : quelles espèces chimiques sont présentes au cours du titrage.
- pour la mesure conductimétrique au cours du titrage.