Formule toujours donnée : / à savoir :
\(\left [ \mathrm{H_3O^+} \right ] = 10^{-pH}
\)
OU
\(pH = -\mathrm{log} (\left [ \mathrm{H_3O^+} \right ])
\)
Je sais effectuer un calcul si …
- J’ai écrit la formule littérale adéquate
- J’ai personnalisé la formule littérale
- J’ai calculé correctement (calculette + conversion)
- J’ai mis le bon nombre de chiffres significatifs CS
- J’ai mis la bonne unité à la fin du calcul
Cours à consulter
Liste des exercices
Exercice 1 : pH acide
Soit une solution d’acide chlorhydrique de concentration molaire à 0,0267 mol/L. Sachant que c’est un acide fort, déterminer le pH de la solution.
L’équation de réaction avec l’eau est : HCℓ(aq) + H2O(ℓ) ⇄ Cℓ–(aq) + H3O+(aq)
Etant un acide fort, on peut écrire : C(HCℓ) = [ H3O+ ], alors
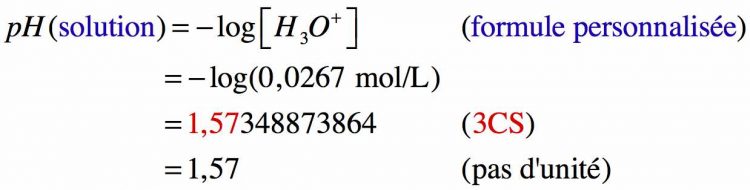
Donc le pH de la solution d’acide chlorhydrique est de 1,57.
Exercice 2 : pH basique
Soit une solution d’hydroxyde de sodium de concentration molaire à 2,0 mmol/L. Sachant que c’est une base forte, déterminer le pH de la solution.
Etant une base forte, on peut écrire : C(NaOH) = [ HO– ], alors
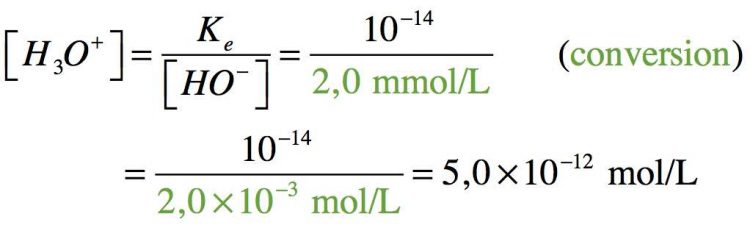
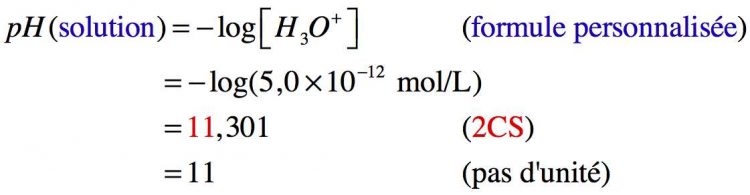
Donc le pH de la solution d’hydroxyde de sodium est de 11.
Exercice 3 : Acide fort ou faible ?
Soit une solution d’acide éthanoïque de concentration à 53,5 mmol/L. Le pH de la solution est de 2,5. L’acide éthanoïque est-il un acide faible ou fort ?
Si l’acide éthanoïque était un acide fort alors : C(CH3COOH) = [ H3O+ ] = 53,5 mol/L. Est-ce vrai ?

L’acide éthanoïque est donc un acide faible. On écrira la réaction de l’acide éthanoïque dans l’eau avec une double flèche :
CH3COOH + H2O(ℓ) ⇄ CH3COO–(aq) + H3O+(aq)


très bon exercices je recommande, en tant qu’élève de rhéto ils m’ont beaucoups aidés.