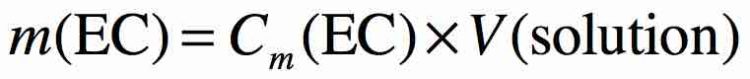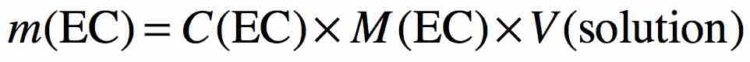- Pesée du solide : balance, coupelle de pesée, spatule
- Dissolution avec le solvant : Fiole jaugée, bouchon, entonnoir



A voir dans ce cours
Autres cours à consulter
La dissolution : modèle et explication
Dissolution du sucre
La dissolution du sucre solide (ou glucose C6H12O6) dans l’eau se modélise par l’équation chimique de dissolution suivante :
C6H12O6 (s) → C6H12O6 (aq)
Dissolution du sel
La dissolution du sel solide (ou chlorure de sodium NaCl) dans l’eau se modélise par l’équation chimique de dissolution suivante :
NaCl(s) → Na+(aq) + Cl–(aq)
Explications
Comme nous le montre la vidéo ci-dessous, au cours d’une dissolution, l’eau ne réagit pas avec le soluté : les molécules H2O ne font que « détacher » les constituants du soluté (= des ions ou des molécules)
En classe de première, on parle de solvatation : les molécules d’eau H2O diminuent les interactions au sein du soluté ce qui entraine un détachement progressif de l’ensemble de ses constituants.
C’est pour cela que lorsque nous modélisons la dissolution, les molécules d’eau n’interviennent pas dans l’équation de réaction.
La dissolution du point de vue des atomes
Source – chaine Youtube : « Musée canadien de la nature »
Protocole d'une dissolution

2/ Tarer une balance avec une coupelle de pesée dessus.

3/ Prélevez m g de votre espèce chimique (EC) solide à l’aide d’une spatule.

4/ Transvasez l’EC dans une fiole jaugée de V mL à l’aide d’un entonnoir.
Pourquoi ? Afin de ne pas mettre notre EC à coté de la fiole.

5/ Rincez la coupelle et l’entonnoir à l’eau distillée ; l’eau de rinçage doit être versée dans la fiole jaugée.
6/ Remplissez à moitié la fiole avec de l’eau distillée ; bouchez puis secouez
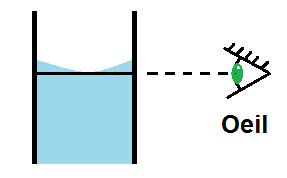
7/ Remplissez la fiole jusqu’au trait de jauge avec de l’eau distillée ; bouchez puis secouez.